 氧化还原反应的基本概念和关系.docx
氧化还原反应的基本概念和关系.docx
《氧化还原反应的基本概念和关系.docx》由会员分享,可在线阅读,更多相关《氧化还原反应的基本概念和关系.docx(30页珍藏版)》请在课桌文档上搜索。
1、氧化还原反应的基本概念和关系适用学科化学适用年级高一适用区域新课标本讲时长分钟60知识点 氧化还原反应的概念、本质与特征 氧化还原反应的有关概念及其关系氧化还原反应与四种基本反应类型教学目标知识与技能.从得氧和失氧、化合价变化的分类标准认识氧化还原反应的概念。2. 应用电子转移的观点进一步理解氧化还原反应。 3. 应用电子转移的观点判断、分析氧化还原反应,并能举例说明化学反应中元素化合价的变化与电子转移的关系。4. 认识氧化还原反应中各有关物质的相互关系。 过程与方法.经过对氧化还原反应探究的过程,理解科学探究的意义,学习科学探究的基本方法,提高科学探究能力。2. 培养学生用概念去分析问题、解
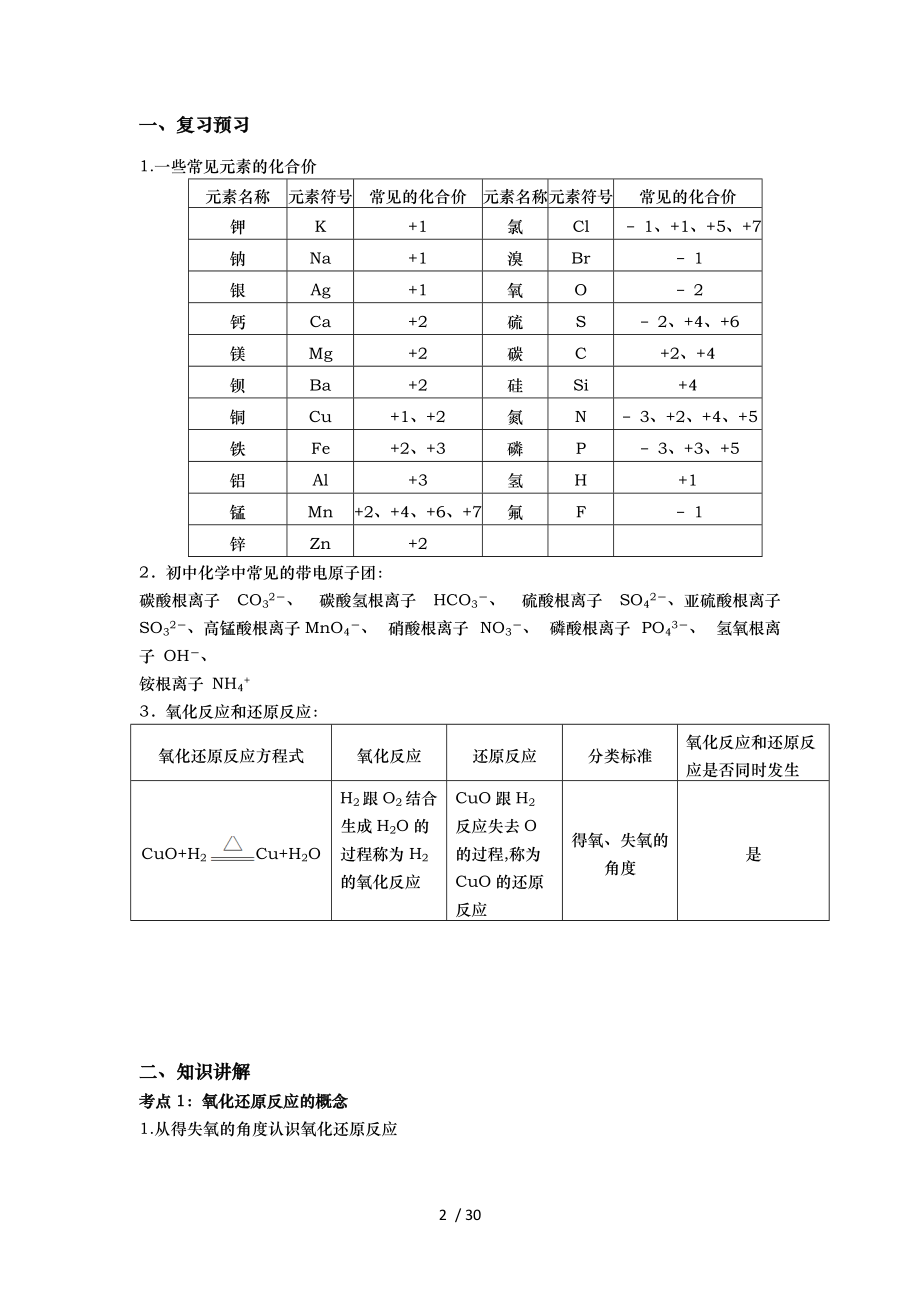
2、决问题的能力,培养学生的归纳能力、推理能力。情感、态度与价值观对学生进行对立统一等辩证唯物主义观点的教育,使学生形成勇于创新的习惯、培养创新能力。教学重难点 1.氧化还原反应的实质 2.氧化还原反应的有关概念及其关系教学过程一、复习预习1.一些常见元素的化合价元素名称元素符号常见的化合价元素名称元素符号常见的化合价钾K+1氯Cl 1、+1、+5、+7钠Na+1溴Br 1银Ag+1氧O 2钙Ca+2硫S 2、+4、+6镁Mg+2碳C+2、+4钡Ba+2硅Si+4铜Cu+1、+2氮N 3、+2、+4、+5铁Fe+2、+3磷P 3、+3、+5铝Al+3氢H+1锰Mn+2、+4、+6、+7氟F 1锌Z
3、n+22初中化学中常见的带电原子团:碳酸根离子 CO32、 碳酸氢根离子 HCO3、 硫酸根离子 SO42、亚硫酸根离子 SO32、高锰酸根离子MnO4、 硝酸根离子 NO3、 磷酸根离子 PO43、 氢氧根离子 OH、铵根离子 NH4+3氧化反应和还原反应:氧化还原反应方程式氧化反应还原反应分类标准氧化反应和还原反应是否同时发生CuO+H2Cu+H2OH2跟O2结合生成H2O的过程称为H2的氧化反应CuO跟H2反应失去O的过程,称为CuO的还原反应得氧、失氧的角度是二、知识讲解考点1:氧化还原反应的概念1.从得失氧的角度认识氧化还原反应结论:根据得失氧的情况,得到氧的反应是氧化反应;失去氧的
4、反应是还原反应。一种物质被氧化,另一种物质被还原的反应叫氧化还原反应。2从元素化合价升降的角度认识氧化还原反应结论:根据化合价升降情况,所含元素的化合价升高的物质发生氧化反应;所含元素化合价降低的物质发生还原反应。反应前后有元素化合价升降的反应叫氧化还原反应。3从电子转移的角度认识氧化还原反应结论:根据元素的化合价变化与电子得失或电子对偏移的关系,从电子得失的角度分析失去电子的反应为氧化反应,得到电子的反应为还原反应。凡有电子转移的化学反应叫氧化还原反应。4.小结氧化还原反应的本质是电子转移;特征是反应前后元素的化合价发生变化。判断方法为标明元素的化合价,分析元素的化合价是否变化。考点2:氧化
5、还原反应与四种基本反应类型的关系.置换反应一定是氧化还原反应;.分解反应一定不是氧化还原反应;.单质参加的化合反应和有单质生成的分解反应是氧化还原反应。关系如图所示:考点3:氧化还原反应的基本概念1.氧化剂和还原剂氧化剂: 得到电子或电子对偏向的物质-所含元素化合价降低的物质还原剂:失去电子或电子对偏离的物质所含元素化合价升高的物质2.氧化产物和还原产物氧化产物:氧化反应得到的产物还原产物:还原反应得到的产物3.氧化性和还原性 氧化性:氧化剂得电子的能力。还原性:还原剂失电子的能力。4. 氧化反应和还原反应氧化反应被氧化:指反应物中的某元素失电子、化合价升高的反应过程。氧化反应的对象是反应物中
6、的某元素;氧化反应的本质是元素的原子失去电子;氧化反应的特征是元素化合价升高;氧化反应对反应过程而言。还原反应被还原:指反应物中某元素得电子、化合价降低的反应过程。还原反应的对象是反应物中的某元素;还原反应的本质是元素的原子得到电子;还原反应的特征是元素化合价降低;还原反应对反应过程而言考点4:氧化还原反应概念之间的关系三、例题精析例题1以元素化合价升降的观点分析下列各化学反应,其中不属于氧化还原反应的是AMg2HCl=MgCl2H2BH2Cl22HClCCuOH2CuH2ODCaCl2Na2CO3=CaCO32NaCl答案D解析只要是反应前后存在元素化合价升降的化学反应,都属于氧化还原反应。
7、例题2四种基本反应类型与氧化还原反应的关系可用如图表达。其中为化合反应,则为_反应。写出有关水生成的符合反应类型的一个化学方程式:_。写出有水参加的符合反应类型的一个化学方程式_,其中水为_剂。答案分解NaOHHCl=NaClH2O2Na2H2O=2NaOHH2氧化解析因为化合反应和分解反应,都是部分属于氧化还原反应,部分属于非氧化还原反应,故若为化合反应,则为分解反应。进而判断出为复分解反应,为置换反应,可分别举以下两个例子:NaOHHCl=NaClH2O,2Na2H2O=2NaOHH2。例题3已知下列四个反应:2Na2H2O=2NaOHH22F22H2O=4HFO2Cl2H2O=HClHC
8、lOCH2OCOH2试从氧化还原的角度,回答下列问题:水只作氧化剂的是_;水只作还原剂的是_;水既不作氧化剂又不作还原剂的是_。答案解析H2O中H元素为1价,当生成H2时,氢元素化合价降低,此时H2O作氧化剂;H2O中O元素为2价,当生成O2时,氧元素化合价升高,此时H2O作还原剂。因此,结合、四个反应方程式的特点可知、中H2O只作氧化剂,中H2O只作还原剂,中H2O既不作氧剂又不作还原剂。例题4下列反应既是离子反应,又是氧化还原反应的是ABaCl2溶液中滴加稀H2SO4B盐酸和氧化铁反应C铁片放入CuSO4溶液中D氢气还原CuO答案C解析A、B、C项对应的反应为离子反应,但A、B中的反应为复
9、分解反应,C中的反应为置换反应,FeCuSO4=FeSO4Cu,FeCu2=Fe2Cu。例题5制备氰氨基化钙的化学方程式为CaCO32HCN=CaCN2COH2CO2,在反应中 A氢元素被氧化,碳元素被还原BHCN是氧化剂,CaCO3是还原剂CCaCN2是氧化产物,H2为还原产物DCO为氧化产物,H2为还原产物答案C解析该题的最关键的一点是分析各元素的化合价变化,难点是碳元素在HCN和CaCN2中的化合价,从反应物CaCO3到生成物CO2,碳的化合价均为4价,没有改变,再从生成物H2分析发现氢的化合价降低,显然HCN中H得电子,HCN是氧化剂,而CaCO3中的各元素化合价均无变化,则还原剂也必
10、是HCN,其中的碳元素一定被氧化,在HCN中碳为2价,CO中的碳也为2价,则CaCN2中的碳为4价,故CaCN2为氧化产物。四、课堂运用基础1. 某元素在化学反应中,由化合态变为游离态,则该元素A一定被氧化 B一定被还原C可能被氧化,也可能被还原 D化合价降低为02. 有下列几组反应:AZn2HCl=ZnCl2H2BCO2H2O=H2CO3CSO2SO2 DBa2H2SO4=BaSO42H2OENa2CO32HCl=2NaClH2OCO2FCaCO3CaOCO2GCH42O2CO2H2OH2KClO32KCl3O2以上反应中,属置换反应的是_,属化合反应的是_,属分解反应的是_,属复分解反应的

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 氧化 还原 反应 基本概念 关系
 课桌文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
课桌文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。





链接地址:https://www.desk33.com/p-13249.html